Prinsipyo ng pagpapatakbo ng baterya
Paano gumagana ang isang wall clock, isang TV remote control, o isang radio-controlled na laruang pambata? Karamihan sa mga tao, nang walang pag-aalinlangan, ay sasagot "mula sa mga baterya" at, sa prinsipyo, sila ay tama. Ngunit malamang na hindi masasabi ng sinuman sa kanila kung paano eksaktong triple ang portable na baterya, kung paano ito gumagana, at kung wala ito ay imposible ang buong proseso ng pagpapadala ng electric current mula sa baterya hanggang sa end consumer. Punan natin ang nakakainis na puwang na ito sa kaalaman.
Ang nilalaman ng artikulo
Prinsipyo ng pagpapatakbo ng baterya
Upang maunawaan ang prinsipyo ng pagpapatakbo ng isang maginoo na baterya ng AA, kailangan mong magkaroon ng pangkalahatang pag-unawa sa istraktura nito. Kaya, ang anumang baterya ay binubuo ng tatlong pangunahing elemento - anode, cathode at electrolyte. Bukod dito, ang huli ay maaaring magkaroon ng halos anumang estado ng pagsasama-sama: ang katod at anode na inilagay sa isang solusyon sa asin, sa prinsipyo, ay isa ring "baterya," lamang sa isang anyo na hindi karaniwan para sa karaniwang tao.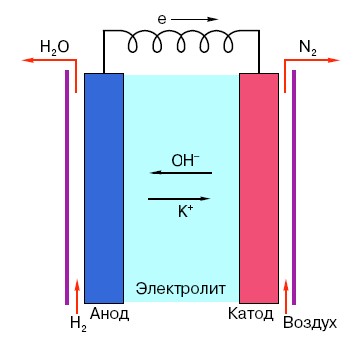
Interesting! Ang tinatawag na "voltaic column", na imbento ni Alessandro Volta, ay mayroon ding lahat ng mga elemento na kinakailangan para sa produksyon ng electric current. Binubuo ito ng mga plato ng sink at tanso na nakasalansan sa ibabaw ng bawat isa, sa pagitan ng kung saan ang isang tela na babad sa acid ay inilagay bilang isang "layer".
Ang anode sa naturang mga sistema ay ang pangunahing pinagmumulan ng mga electron, na, tulad ng alam natin mula sa isang kurso sa pisika ng paaralan, ay may negatibong singil.Ang mga negatibong sisingilin na mga particle ay naaakit sa mga positibo, at sa kasong ito ang ibabaw ng cathode ay kumikilos bilang isang "plus".
Ngunit ito ay hindi sapat para sa isang electric current na mangyari, dahil ang mga electron ay nangangailangan din ng isang uri ng "highway" - isang daluyan na susuporta sa interaksyon ng cathode at anode. Narito na ang isang electrolyte ay lilitaw "sa entablado" - isang asin, alkali o acid na may kakayahang magsagawa ng kasalukuyang.
Tingnan natin ang prinsipyo ng pagpapatakbo gamit ang isang tiyak na halimbawa: mayroong isang baterya na na-rate sa 18 volts. Ang boltahe sa pagitan ng mga electrodes sa loob nito ay matatag hanggang sa ito ay konektado sa network. Sa sandaling lumitaw ang isang mamimili (halimbawa, isang ordinaryong bombilya), ang boltahe ay nagsisimula nang unti-unting bumaba, ang kasalukuyang ay nagsisimulang dumaloy mula sa "negatibong" elektrod patungo sa "positibo", at ang isang kemikal na reaksyon ay nangyayari sa electrolyte na naglalayong pagpapanatili ng potensyal na pagkakaiba sa pagitan ng mga electrodes.
Sanggunian. Kung mas maraming enerhiya ang kailangan ng mamimili, mas matindi ang reaksyon sa loob ng baterya at mas mabilis itong mabibigo.
Paano gumagana ang isang rechargeable na baterya, kung paano ito naiiba sa isang regular
Kaya, tiningnan namin ang mga klasikong "daliri" at "maliit na daliri" na mga baterya at alam namin na ang buhay ng serbisyo ng karamihan sa kanila ay mahigpit na limitado (kahit na ano ang sabihin ng mga sikat na tagagawa). Ngunit ano ang tungkol sa tinatawag na mga baterya - mga baterya na uri ng baterya na hindi lamang maaaring kumonsumo ng enerhiya sa panahon ng proseso ng reaksyon, ngunit maipon din ito at iimbak ito ng mahabang panahon?
Upang maunawaan ang prinsipyo ng pagpapatakbo ng baterya, kinakailangan na bumaling sa kimika. Kunin natin bilang halimbawa... Isang regular na uling na apoy.Gaano man kaganda at kaakit-akit ang hitsura ng apoy, alam ng sinumang chemist na nagmamasid dito na ang prosesong ito ay isang pangmatagalang reaksyon lamang ng fuel oxidation. Ang nasusunog na karbon ay nakikipag-ugnayan sa oxygen at bilang resulta ng reaksyong ito ay nakukuha natin ang:
- carbon dioxide;
- liwanag;
- mainit-init.
At kung ang huling dalawang punto ay may kakayahang magpainit ng kaluluwa at katawan, kung gayon hindi natin magagamit ang carbon dioxide sa anumang paraan, dahil ito ay isang by-product ng reaksyon, na, sa katunayan, ang basura nito. Hihinto ang reaksyon ng oksihenasyon kapag naubos ang mga panimulang elemento: oxygen at karbon. Ang paghinto ng reaksyon sa isang baterya ay nangyayari sa parehong paraan kapag ang mga panimulang sangkap ay ganap na naubos at tanging "basura" na lamang ang natitira.
Sa baterya, ang lahat ay nangyayari nang medyo naiiba. Ang katotohanan ay ang reaksyon na nagaganap dito ay kabilang sa kategorya ng nababaligtad, iyon ay, sa ilalim ng ilang mga kundisyon maaari itong "baligtarin", ibalik ang lahat ng mga sangkap sa kanilang orihinal na estado. Ito ay ang posibilidad ng isang reversible reaction na nagaganap sa baterya na nagpapahintulot na ito ay ma-charge.
Sa isang baterya na konektado sa network, ang reaksyon ay nagpapatuloy sa kabaligtaran na direksyon, at ang kasalukuyang dumadaloy mula sa "plus" hanggang sa "minus", at hindi sa kabaligtaran. Bilang resulta, ang produkto ng reaksyon ay bumubuo ng mga panimulang sangkap, at ang may-ari ng baterya ay tumatanggap ng magagamit na "nabawi" na enerhiya sa isang portable na format. Iyon lang!





