DIY na baterya: mula sa lemon, barya, patatas, garapon
Marahil para sa ilan ito ay magiging isang pagtuklas na kasingkahulugan ng pagkatuklas ni Columbus sa Amerika, na mayroong kuryente sa lahat ng dako sa paligid natin. Ito ay literal na tumatagos sa ating buong buhay. Ngunit kahit na malaman ito kung minsan ay hindi pumipigil sa ating mga mata na lumaki kapag nalaman natin na ang tensyon ay maaaring makuha mula sa pinakakaraniwang bagay at maging sa pagkain. Gamit ang mayroon ka sa kusina o garahe, posible na bumuo ng isang simpleng baterya sa bahay. 
Ang nilalaman ng artikulo
baterya ng lemon
Kahit na mula sa prutas na ito maaari kang makakuha ng kuryente. Upang gawin ito kailangan mong ihanda ang mga sumusunod na bagay:
- isang limon;
- isang piraso ng isang bagay na bakal;
- isang bagay na gawa sa tanso;
- at dalawang piraso ng kawad para sa pagkakabukod.
Una ay kailangan nating linisin ang ating mga bagay na bakal at tanso. Ang regular na papel de liha ay makakatulong dito.
Sanggunian. Ang isang bagay na gawa sa bakal ay maaaring ang pinakakaraniwang mga kuko. Marami sa kanila sa anumang garahe. At para sa "isang bagay na gawa sa tanso", maaari kang gumamit ng mga barya sa mga denominasyon ng sampu at limampung kopecks.
Ngayon ay naglalagay kami ng isang pako at isang barya sa lemon. Sa pagitan ng mga ito kailangan mong gumawa ng isang puwang ng mga tatlong sentimetro. Ito ang magiging aming mga electrodes, ang natitira lamang ay ikonekta ang mga wire sa kanila. Maaari mo lamang itong idikit sa tabi nito. Ang barya ay ang aming positibong kontak, at ang pako, samakatuwid, ay negatibo. 
Sanggunian. Ang lemon ay maaaring matagumpay na mapalitan ng isang ordinaryong mansanas.Ang pangunahing bagay ay piliin ang pinaka maasim na hindi mo iniisip na gamitin para sa mga eksperimento. At ang acid ay kapaki-pakinabang para sa reaksyon upang magpatuloy.

Ang baterya ng lemon o mansanas (kung kukuha ka lamang ng isang prutas) ay magbubunga ng mga 0.5 o 0.7 volts. Napakaliit nito - hindi ka makakapag-charge kahit na ang pinakasimpleng mobile phone. Kailangan mong kahit papaano ay dalhin ang boltahe sa tatlo o kahit limang volts. Pero paano? Oo, ito ay napaka-simple - ikonekta ang higit pang mga prutas sa isang solong chain.
Sanggunian. Upang madagdagan ang singil ng aming circuit, maaari itong singilin. Ito ay sapat na upang isama ang isang baterya ng korona o kahit isang charger ng mobile phone sa circuit.

Nagiging posible ang paggawa ng mga limon o mansanas sa paggawa ng kuryente dahil nakikipag-ugnayan ang elementong tanso sa elementong bakal. Ang acid na nasa loob ng prutas ay nagpapalitaw ng reaksyong ito. Hangga't mayroong kahit isang patak ng acid sa loob o hangga't buo ang mga contact, patuloy na gagana ang baterya.
Kuryente sa isang bangko
Kahit na mula sa isang ordinaryong lata maaari kang bumuo ng isang bagay na katulad ng pinakaunang baterya sa mundo. Upang gawin ito kakailanganin mo:
- isang simpleng garapon ng salamin (maaari kang gumamit ng baso);
- sink o aluminyo plato;
- strip ng tanso;
- ilang mga wire;
- ammonia, na kilala rin bilang ammonium chloride;
- tubig sa gripo.
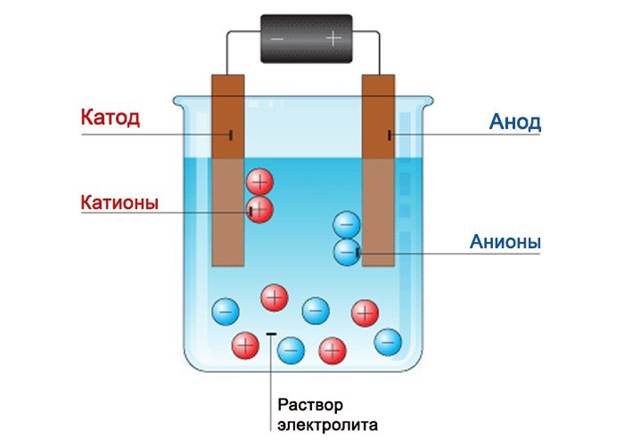
Ang aming baterya ay magkakaroon ng aluminum plate bilang anode, at isang copper plate ang magsisilbing cathode. Dapat piliin ang kanilang sukat upang ang kanilang lugar ay katumbas ng palad ng isang tao. Gagawin nitong mas mahusay ang ating baterya. Ihinang ang mga wire sa mga plato. Ngayon ang aming gawain ay i-install ang mga plato sa garapon upang hindi sila magkadikit. At ang taas ng mga plate na ito ay dapat na mas malaki kaysa sa lata mismo.
Panahon na ng electrolyte. Madaling gawin. Paghaluin ang ammonia sa tubig. Para sa bawat 0.1 litro ng tubig kailangan mong magdagdag ng 50 gramo ng pulbos.Paghaluin ang lahat nang lubusan at ibuhos sa isang garapon. Sa halip na ammonia, maaari mo ring gamitin ang sulfuric acid. Upang gawin ito, kakailanganin itong dalhin sa isang dalawampung porsyentong estado.
Mahalaga! Kung gumawa ka ng isang electrolyte batay sa sulfuric acid, pagkatapos ay kapag diluting ito kailangan mong ibuhos ang acid sa tubig, ngunit hindi vice versa. Kung hindi, ang tubig ay maaaring kumulo lamang, at bilang isang resulta ng isang marahas na reaksyon, ang lahat ay tilamsik. Bilang karagdagan, huwag kalimutan na kapag nagtatrabaho sa acid kailangan mong magsuot ng proteksiyon na kagamitan.
Punan ang garapon ng nagresultang solusyon. Kung pagsasamahin mo ang ilang mga lata sa isang solong circuit, makakakuha ka ng isang napakahusay na baterya, ang enerhiya nito ay sapat na upang singilin ang isang medyo malakas na aparato. Ang bateryang ito ay katulad ng mga bateryang asin.
DIY coin na baterya
Kahit na ang mga barya na nasa iyong wallet o alkansya ay maaaring makabuo ng electric current. Mula sa mga barya maaari kang bumuo ng pinakasimpleng galvanic cell, na sa agham ay tinatawag na Voltaic column. Kailangan nating maghanda:
- ilang mga tansong barya (tulad ng mga barya ng limampu at sampung kopecks);
- foil ng pagkain;
- ilang mga sheet ng papel;
- suka ng mesa o isang solusyon ng tubig at asin.

Ngayon, tipunin natin ang ating column ng enerhiya:
- Kumuha kami ng isang piraso ng papel, ibabad ito sa suka at ilakip ito sa isang barya.
- Ilagay ang foil sa papel.
- Ngayon muli ang barya.
- Hanggang matapos naming idagdag ang mga barya, inuulit namin ang lahat nang sunud-sunod.
- Bilang resulta, magkakaroon ng barya sa isang dulo ng istraktura. Ito ang positibong poste, ang kabilang dulo ay magkakaroon ng foil. Ito ang negatibong poste.
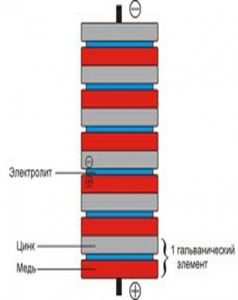
Ang mas maraming mga barya na maaari mong kolektahin, mas malaki ang pag-igting. Ang mga barya ay hindi maaaring gamitin muli. Pagkatapos ng eksperimento magiging kalawangin na sila.
Kuryente sa lata ng beer
Pagkatapos uminom ng de-latang beer, huwag magmadaling itapon ang walang laman na lata. Gagawa ito ng magandang baterya. Upang gawin ito kakailanganin mo:
- lata ng beer (ginawa sila mula sa food grade aluminum);
- apoy na uling o alikabok ng karbon;
- paraffin kandila;
- graphite pencil lead;
- tubig at asin;
- isang piraso ng foam plastic - ang foam ay dapat na higit sa isang sentimetro ang kapal.
Putulin ang tuktok ng lata. Pinutol namin ang isang bilog mula sa foam plastic upang ang diameter nito ay tumutugma sa garapon. Gumagawa kami ng isang butas sa foam, ngunit hindi sa pamamagitan ng. Maglalagay kami ng isang graphite rod sa butas. Ilagay ang polystyrene foam sa ilalim ng garapon at ipasok ang baras. Ang graphite rod ay dapat na eksaktong nasa gitna ng lata. Pinupuno namin ang lahat sa paligid ng baras ng alikabok ng karbon.
Mahalaga! Siguraduhin na ang pamalo ay hindi hawakan ang mga dingding ng garapon.
Ngayon gumawa kami ng solusyon ng asin at tubig. Upang gawin ito, kumuha ng kalahating litro ng tubig at magdagdag ng tatlong kutsara ng asin dito. Paghaluin ang lahat nang lubusan upang ang lahat ng asin ay ganap na matunaw. Ito ay matutunaw nang mas mabilis at mas mahusay kung ang tubig ay pinainit. Ibuhos namin ang aming electrolyte sa isang garapon at tinatakan ang lahat ng paraffin. Ang graphite rod ay dapat tumaas sa itaas ng antas ng lata.
Ikinonekta namin ang isang wire sa baras - ito ang positibong contact. At ang pangalawang kawad sa dingding ng lata ay ang negatibong kontak.Kung gumawa ka ng isang circuit ng dalawang lata, maaari kang makakuha ng boltahe ng tatlong volts. Ang bateryang ito ay maaaring magpaandar ng bumbilya.
Baterya ng patatas
Kung mayroon kang patatas sa bahay, kung gayon ito ay isang masiglang bagay. Totoo, isang beses na paggamit. Isang beses lang magagamit ang baterya ng patatas. Halimbawa, sa paglalakad.
Upang makuha ang baterya, ihahanda namin ang mga sumusunod na elemento:
- kakailanganin mo ng malalaking patatas;
- mga wire ng tanso sa pagkakabukod;
- toothpaste;
- wood chips o toothpick;
- asin.
Gupitin ang patatas sa dalawang bahagi. Maipapayo na gawin ito nang pahaba upang makakuha ng mas malaking lugar ng pagputol. Gupitin ang core sa isang kalahati upang lumikha ng isang butas. Maglagay ng pinaghalong toothpaste at asin sa butas na ito. Dapat punan ng komposisyon ang buong recess. Ang halo na ito ay magsisilbing electrolyte.
Gumagawa kami ng dalawang butas sa isa pang piraso ng patatas. Ang distansya sa pagitan ng mga butas ay dapat na tulad na pareho ay matatagpuan sa itaas ng electrolyte mixture kapag ang parehong mga halves ay konektado. Ang mga butas na ito ay kinakailangan para sa mga wire. Ang mga dulo ng mga wire ay dapat na alisin ang pagkakabukod sa isang haba ng dalawang sentimetro. Ngayon ikinonekta namin ang parehong mga bahagi ng patatas at, upang hindi sila masira, inaayos namin ang mga ito gamit ang mga toothpick.
Naghihintay kami ng limang minuto para magsimula ang reaksyon. Ngayon isinasara namin ang mga wire at nakikita ang isang spark sa dulo. Ito ay kung paano mo ligtas na makapagsindi ng apoy gamit ang baterya ng patatas sa isang camping stop.
Konklusyon
Naturally, ang lahat ng mga opsyon sa baterya na isinasaalang-alang, bagaman gumagana ang mga ito, ay hindi maaaring ganap na mapapalitan ang alinman sa isang baterya o isang nagtitipon. Ngunit sino ang pumipigil sa iyo na gawin ang mga naturang eksperimento upang mas maunawaan ang istruktura ng mga pisikal na elemento at prosesong kemikal na ito?





